当地时间3月31日,顶级学术期刊《细胞》(Cell)在线发表了中国团队的一项最新研究,题为“针对SARS-CoV-2和新出现变异株的环状RNA疫苗”(Circular RNA Vaccines against SARS-CoV-2 and Emerging Variants)。该研究首次报道了环状RNA疫苗技术平台,以及据此开发的针对新冠病毒及其一系列变异株的环状RNA疫苗。
北京大学生命科学学院教授魏文胜课题组博士后璩良、博士研究生伊宗裔和沈勇为论文共同第一作者,魏文胜系通讯作者。此外,北京大学谢晓亮教授/曹云龙研究员课题组、中国医学科学院/北京协和医学院王健伟教授课题组、中国医学科学院医学生物学研究所彭小忠教授课题组、中国食品药品检定研究院王佑春课题组及黄维金课题组等均提供了支持。
实际上,该研究于今年1月在预印本bioRxiv提前发布,而和团队在去年3月发表的 bioRxiv论文相比,他们继小鼠后在恒河猴上也验证了他们开发的编码新冠病毒刺突蛋白三聚体受体结合域(RBD)的环状RNA疫苗(circRNA^RBD)能够引发有效的中和抗体和T细胞应答。
研究团队指出,该项研究中制备的针对新冠病毒德尔塔变异株的环状RNA疫苗(circRNA^RBD-Delta)对多种新冠病毒变异株具有广谱保护力。他们认为,该疫苗可作为具有广谱保护力的新冠候选疫苗,也为针对当前新冠变异株迅速传播的疫苗研发和接种策略提供了参考依据。
新冠肺炎病毒circRNA疫苗研发示意图。
新疫苗的需求及mRNA疫苗技术制约
论文中写道,随着疫情的发展,出现了具有免疫逃逸能力的变异株,其中最严重的是奥密克戎(Omicron),该毒株现已成为全球大流行的主导毒株。其在刺突蛋白(S蛋白)上携带30多个突变,其中15处位于受体结合域(RBD),导致此前研发的中和抗体的有效性显著下降。
研究团队认为,尽管通过原有的SARS-CoV-2疫苗加强针接种后,可以部分提高其中和能力,但奥密克戎伪病毒的中和能力仍比野生型低4-13倍。这对现有疫苗的效力构成了严峻的挑战,突出表明迫切需要开发针对这种快速传播的变异株的有效疫苗。
传统的灭活、病毒样颗粒等疫苗平台已被用于开发新冠疫苗,且证明了安全性和有效性。当然,在这场疫情中,最受瞩目的是,针对新冠病毒的mRNA疫苗以极快的速度开发出来,并迅速被批准使用。而在此之前,该疫苗开发策略仍处于临床试验阶段,也从未被用于商业用途。
作为近几年兴起的突破性医学技术,mRNA疫苗的基本原理是通过脂纳米颗粒(LNP)将mRNA导入体内来表达抗原蛋白,以刺激机体产生特异性免疫反应。COVID-19爆发后,莫德纳的mRNA-1273、辉瑞/BioNTech的BNT162b2,这样的针对性的mRNA疫苗在多种疫苗类型中脱颖而出。
不过,具有生产速度快、成本低,并且能快速应对病毒变异等优点的mRNA疫苗也有着一些短板。例如,其储存和运输条件较为苛刻(零下70℃),并具有潜在的免疫原性副作用。
同时,魏文胜在提供给澎湃新闻(www.thepaper.cn)记者的一份资料中还指出,mRNA疫苗的修饰及递送技术均产生于国外机构,制约了我国mRNA疫苗及其治疗技术的发展和应用,因此亟需发展新型、高效的疫苗技术。
与线性的mRNA不同,环状RNA分子呈共价闭合环状结构,不含5-Cap和3’-polyA结构;且不需要引入修饰碱基, 其稳定性高于线性RNA。环状RNA是非编码RNA中的一大类,它由一种非经典剪接方式即反向剪接(backsplicing)产生。其发现于1976年,并在近几年里成为了新一代的明星分子。
研究团队指出,相比之下,环状RNA由于其共价封闭的环结构而高度稳定,这可以保护其免受外切酶介导的降解。据此前报道,环状RNA比线性mRNA更稳定,在哺乳动物细胞中,环状RNA的中位半衰期至少比线性mRNA长2.5倍。
不过,迄今为止,只有少数内源性环状RNA被证明具有蛋白质翻译模板的功能。天然的环状RNA因为没有5’端的帽子结构,一般无法进行翻译。不过,它可以通过内部核糖体进入位点(IRES)或加入开放阅读框(ORF)上游的m6A修饰来实现蛋白质翻译。
因此,研究团队设想,环状RNA可以作为一个产生免疫原的平台。魏文胜等人也同时指出,RNA的环化方法、纯化策略尚不成熟,其潜在的免疫原性对疫苗研发的影响并不清楚,诸多未知因素也制约着环状RNA的研发应用。
魏文胜对澎湃新闻记者表示,其团队环状RNA疫苗的研发工作在疫情暴发后启动。
论文显示,研究团队采用Group I核酶自催化策略来产生编码SARS-CoV-2 RBD抗原的环状RNA,称为circRNA^RBD。为了增强RBD抗原的免疫原性,在RBD的N端添加了信号肽序列(SP),以实现其分泌表达。在这个结构中,内部核糖体进入位点(IRES)元素置于RBD编码序列之前以启动其翻译。为了增强RBD抗原的免疫原性,他们还将人组织型纤溶酶原激活物(tPA)的信号肽序列融合到RBD的N端,以确保抗原的分泌。
此外,鉴于S蛋白三聚体在结合hACE2方面表现优于单体S蛋白,同时为提高RBD抗原的免疫原性,将T4噬菌体纤维蛋白(Foldon)的三聚化基序融合到其C端。然后将该IRES-SP-RBD-Foldon序列插入环化载体,构建用于产生circRNA^RBD的体外转录(IVT)模板。
初步显示:设计疫苗有效中和奥密克戎株在内的多种变异株
魏文胜等人提到,实验证明,编码新冠病毒刺突蛋白RBD的环状RNA疫苗可以在小鼠和恒河猴体内诱导产生高水平的新冠病毒中和抗体以及特异性T细胞免疫反应,并可以有效降低新冠病毒感染的恒河猴肺部的病毒载量,显著缓解新冠病毒感染引起的肺炎症状。
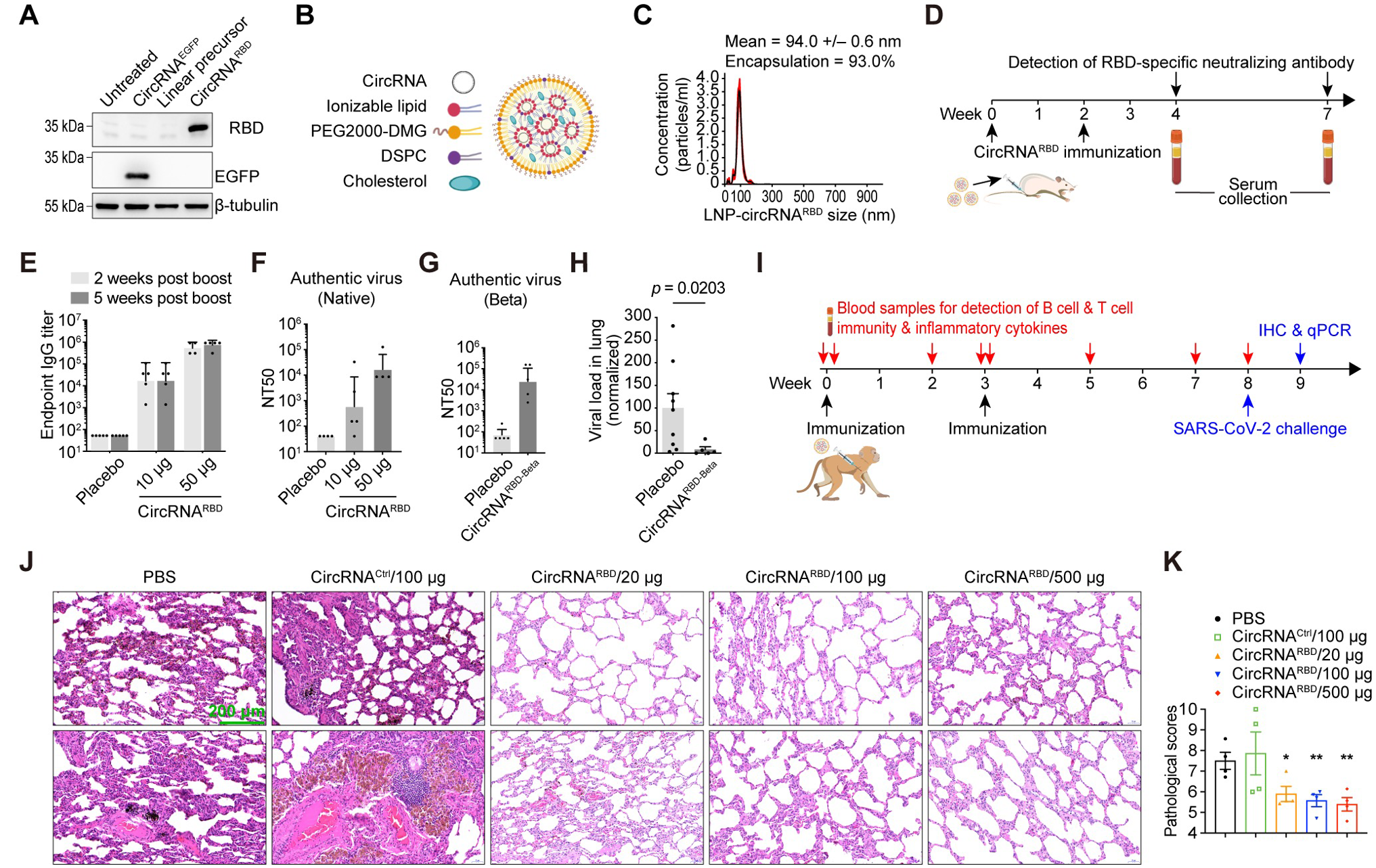
CircRNA疫苗接种在小鼠和恒河猴体内提供了显著性保护。一系列的对比评估表明,与mRNA疫苗相比,circRNA疫苗具有以下特点或优势:circRNA具有更高的稳定性,可以在体内产生更高水平、更加持久的抗原;circRNA疫苗诱导机体产生的中和抗体比例更高,可以更有效地对抗病毒变异,降低疫苗潜在的抗体依赖增强症(ADE)副作用;circRNA疫苗诱导产生的IgG2/IgG1的比例更高,表明其主要诱导产生Th1型保护性T细胞免疫反应,可以有效降低潜在的疫苗相关性呼吸道疾病(VAERD)副作用。
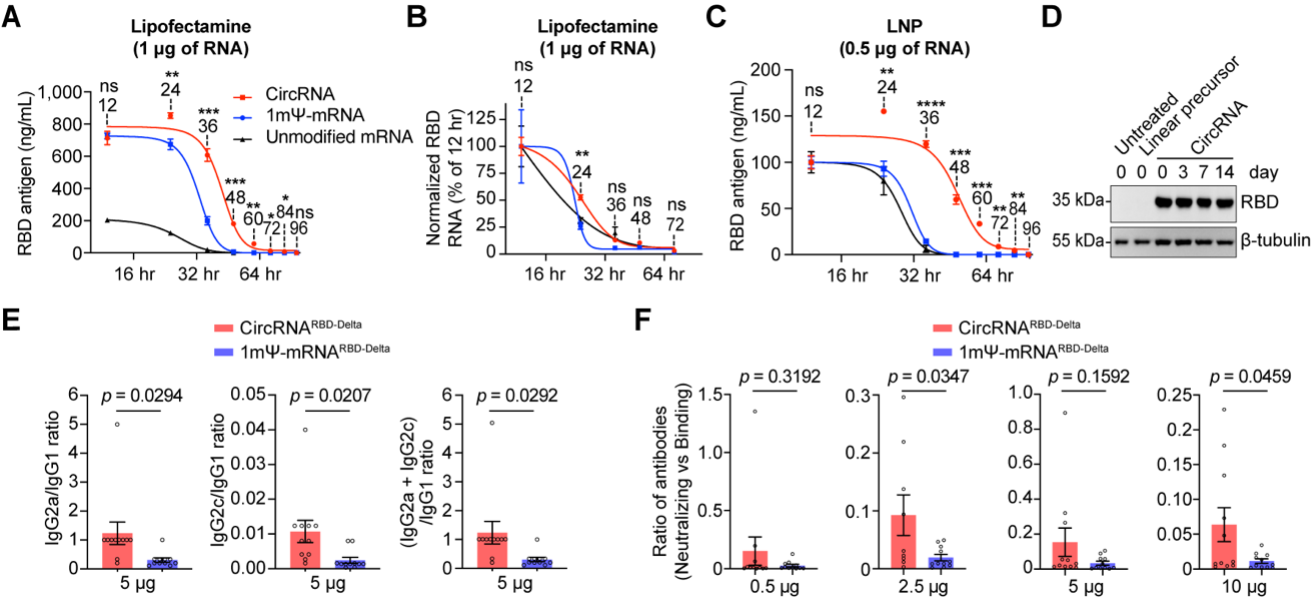
CircRNA疫苗的特点和优势(相比于mRNA疫苗)。此外,值得一提的是,在奥密克戎突变株被世界卫生组织(WHO)列为值得关注的变异株(VOC)后,研究团队还紧急启动了针对该突变株的环状RNA疫苗研发。
在获得病毒序列信息的30天内,研究团队完成了从疫苗生产、小鼠免疫到有效性评估的全流程。研究发现,基于奥密克戎变异株的环状RNA疫苗(circRNA^RBD-Omicron)的保护范围狭窄,其诱导产生的抗体只能够中和奥密克戎变异株。
不过,针对德尔塔变异株设计的环状RNA疫苗(circRNA^RBD-Delta)可以在小鼠体内诱导产生广谱的中和抗体,有效中和包括奥密克戎株在内的多种新冠变异株。他们在讨论中指出,这一针对德尔塔变异株设计的环状RNA疫苗或许可以作为现有疫苗接种后的有效加强针选择,希望进一步的试验能证明这一点。
针对新冠病毒德尔塔变异株设计的circRNARBD-Delta疫苗是一种具有广谱保护力的候选疫苗。此外,研究团队也提到,尽管这项研究工作并没有专门研究疫苗或药物的安全性, 值得注意的是,circRNA疫苗并未在研究中接种后的非人类灵长类动物中引起临床症状或增强病理,这一点为基于环状RNA的疫苗或药物的开发开辟了道路。
研究团队总结称,以上结果表明,针对新冠病毒德尔塔变异株设计的circRNA^RBD-Delta疫苗是具有广谱保护力的新冠肺炎候选疫苗,该研究也为针对当前新冠变异株迅速传播的疫苗研发和接种策略提供了参考依据。
同时,他们认为,该项平台型技术的建立在感染性疾病、自身免疫病、罕见病以及癌症的预防或治疗中也具有广泛的应用前景。
魏文胜表示,后续的主要工作在于推产业化。值得关注的是,据北京大学此前官网报道,魏文胜团队已成功将环状RNA技术转化为生产力,成立圆因(北京)生物科技有限公司,专注于利用环状RNA (circRNA)技术开发疫苗及新型疗法。



