总部位于瑞士的生物技术公司CRISPR Therapeutics在美股周三盘前最高涨超20%,看公司名字就能知道肯定是基因编辑产业发生什么好事了。简单来说,公司发布公告称,美国食品药品监督管理局的细胞、组织和基因治疗咨询委员会,在周二已经完成对CRISPR Therapeutics与福泰制药(VRTX)的基因编辑疗法Exa-cel治疗12岁以上、出现复发性血管闭塞危象患者的严重镰状细胞病(SCD)适应症评估。

(来源:CRISPR Therapeutics)
与过去几年审查疫苗上市资格一样,外部委员会给出的积极意见并不会约束FDA批准上市与否的决策,但FDA一般也会遵循委员会的建议。按照既定的审查日期,FDA将在12月8日对这款药物治疗严重镰状细胞病的资格进行评审,并在明年审批该疗法治疗输血依赖性地中海贫血(TDT)的生物制品许可证。
对于投资市场来说,上面这段话可以简述为:人类历史上首个使用CRISPR/Cas9基因编辑技术治疗基因疾病的疗法有望在一个月后获得FDA批准。
顺便提一句,CRISPR Therapeutics的联合创始人里,就有2020年凭借CRISPR基因编辑获得诺贝尔化学奖的Emmanuelle Charpentier。
潜在的“功能性治愈”希望
根据默沙东诊疗手册,镰状细胞病是血红蛋白(红细胞中的携氧蛋白)的一种遗传性基因异常,特征是红细胞呈镰刀(新月)形并且异常红细胞大量被破坏造成慢性贫血。由于镰状细胞僵硬,所以难以通过身体中最小的血管(毛细血管),导致血流阻塞,引发疼痛、器官损害等后果。
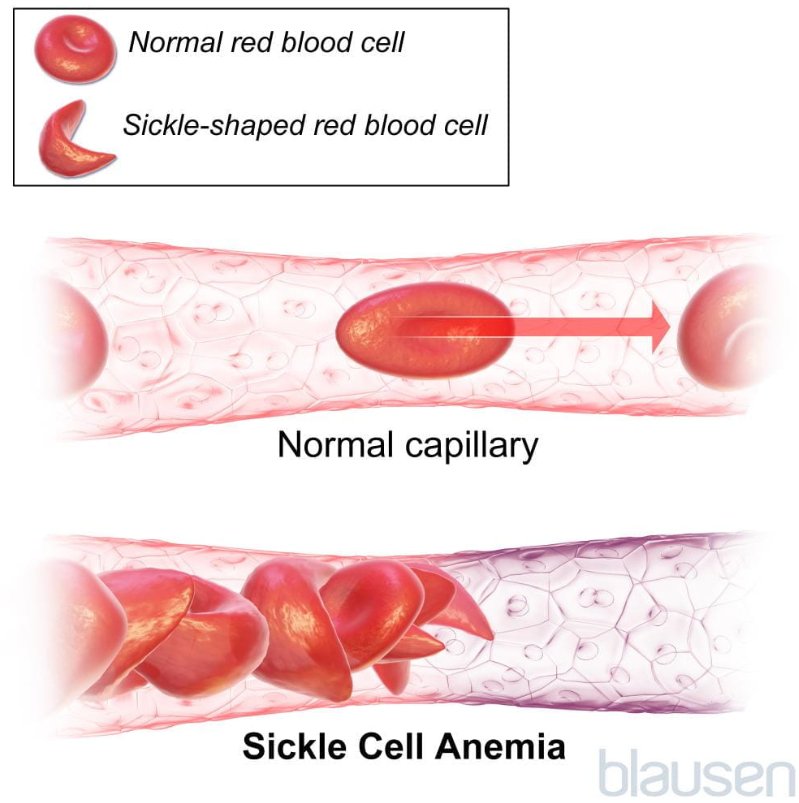
(图示,来源:默沙东诊疗手册、Blausen)
传统上对这种疾病的治疗目的只能是缓解症状和预防危象。虽然可以通过干细胞移植来达到治愈,但患者余生需要一直服用免疫抑制药物。
Exa-cel疗法的原理是通过在体外对患者自己的造血干细胞进行编辑,使得血红细胞生产高水平的胎儿血红蛋白,从而减少SCD患者的血管闭塞危象。同理,这种疗法也能减少TDT患者输血的需求。根据此前的临床试验结果,使用Exa-cel疗法的大多数TDT患者在试验周期内不再需要输血,而所有入组的SCD患者在随访期内没有出现管闭塞性危象。
应用层面也存在短板
对于SCD患者来说,FDA还将在12月20日审批Bluebird Bio的基因疗法。虽然治疗的手段越来越多,但这类疗法普遍有一个问题——贵。
虽然福泰制药并没有披露过Exa-cel的售价,但市场普遍预期单个患者的治疗费用可能会达到上百万美元的水平。作为参考,早些年有针对美国医疗体系的经济研究指出,美国SCD患者终生治疗也非常昂贵,估计每年花费医疗保健系统30亿美元。同时,其他类似的基因疗法花费也要达到数百万美元。
福泰预期,获批上市后大约有2万名患者可能适用于这种疗法,目前联邦医疗补助和私营保险运营商也表现出纳入该药物的兴趣。
而且由于“基因编辑”的定制特性,所以每个患者都需要单独操作,客观上限制了这类疗法的大规模应用。
据介绍,患者首先需要接受骨髓干细胞释放到血液中的治疗,接着连续输血8周,然后取出干细胞送往公司进行处理。与此同时,患者将接受“强烈的化疗”,以清除骨髓中的治疗细胞。最后,经过处理的细胞被输回患者体内,再经过至少一个月的住院停留,确保新细胞生长并重新填充骨髓后才算完整整个疗程。
福泰制药的顾问之一、宾州儿童医院的血液科主任Alexis Thompson博士直白地表示,美国绝大多数医院都无法提供这种疗法。
作为一种崭新的疗法,业界对于CRISPR基因编辑技术也有额外的担忧:如果基因“剪刀”剪错了,可能会破坏基因并导致血癌。虽然在临床试验阶段没有出现这种情况,但福泰的试验只入组了44名患者,跟踪时长超过16个月的只有30人。
对于这个问题,公司通过将入组患者的DNA与大型数据库进行对比来回应这方面的问题,并表示计划追踪临床试验参与者未来15年的变化。专家组对疗法的安全性表示认可,并强调新疗法带来的好处超过潜在的不利因素。
